
Niobium
Saviez-vous ...
SOS Enfants produite ce site pour les écoles ainsi que ce site de vidéo sur l'Afrique . Parrainer un enfant de faire une réelle différence.
| Niobium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
41 Nb | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
gris métallisé, bleu lorsqu'il est oxydé  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | niobium, Nb, 41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / n aɪ oʊ b Je ə m / NY-OH--bee əm; / k ə l ʌ m b Je ə m / kə- LUM -bee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal de transition | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 5, 5, ré | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 92,90638 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Kr ] 4d quatre 5s 1 2, 8, 18, 12, 1 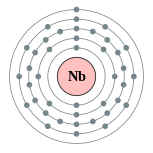 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Charles Hatchett (1801) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Christian Wilhelm Blomstrand (1864) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reconnu comme un distincte élément par | Heinrich Rose (1844) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 8,57 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2750 K , 2477 ° C, 4491 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 5017 K, 4744 ° C, 8571 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 30 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 689,9 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 24,60 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 5, 4, 3, 2, -1 (Légèrement acide oxyde) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,6 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 652,1 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1380 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2416 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 146 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 164 ± 18 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique centré  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (0 ° C) 152 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 53,7 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | 7,3 um / (m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 3,480 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 105 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 38 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 170 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,40 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 6.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 1320 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 736 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-03-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de niobium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Niobium, anciennement niobium, est un élément chimique avec le symbole Nb (anciennement Cb) et de numéro atomique 41. Ce est un doux, gris, ductile de métal de transition , qui est souvent présent dans le pyrochlore minérale, la principale source commerciale pour le niobium, et colombite. Le nom vient de la mythologie grecque : Niobé, fille de Tantale.
Le niobium a des propriétés physiques et chimiques similaires à celles de l'élément de tantale , et les deux sont donc difficiles à distinguer. Le chimiste anglais Charles Hatchett a rapporté un nouvel élément similaire à tantale en 1801 et l'a nommé le niobium. En 1809, le chimiste anglais William Hyde Wollaston conclu à tort que le tantale et le niobium étaient identiques. Le chimiste allemand Heinrich Rose déterminé en 1846 que les minerais de tantale contiennent un deuxième élément, qu'il nomma niobium. En 1864 et 1865, une série de découvertes scientifiques a précisé que le niobium et le niobium étaient le même élément (par opposition à tantale), et pour un siècle les deux noms ont été utilisés de manière interchangeable. Niobium a été officiellement adopté comme le nom de l'élément en 1949.
Ce ne était pas jusqu'à ce que le début du 20e siècle que le niobium a été utilisé pour la première dans le commerce. Le Brésil est le premier producteur de niobium et ferroniobium, un alliage de niobium et de fer. Le niobium est utilisé principalement dans les alliages, la plus grande partie en particulier en acier tel que celui utilisé dans le gaz pipelines. Bien que les alliages contiennent seulement un maximum de 0,1%, ce faible pourcentage de niobium améliore la résistance de l'acier. La stabilité en température de niobium contenant superalliages est important pour son utilisation dans le jet et moteurs de fusée. Le niobium est utilisé dans divers supraconducteurs matériaux. Ces alliages supraconducteurs, contenant également du titane et de l'étain , sont largement utilisés dans le aimants supraconducteurs Scanners IRM. D'autres applications de niobium comprennent son utilisation en soudage, industries nucléaires, l'électronique, l'optique, la numismatique et des bijoux. Dans les deux dernières applications, une faible toxicité et la capacité de niobium à être colorés par anodisation sont des avantages particuliers.
Histoire


Niobium était découvert par le chimiste anglais Charles Hatchett en 1801. Il a trouvé un nouvel élément dans un échantillon minéral qui avait été envoyé en Angleterre à partir de Massachusetts, États-Unis en 1734 par un John Winthrop, et nommé le colombite minérale et le nouvel élément niobium après Britannique, le nom poétique pour l'Amérique . Le niobium découvert par Hatchett était probablement un mélange du nouvel élément de tantale.
Par la suite, il y avait beaucoup de confusion sur la différence entre le niobium (niobium) et le tantale étroitement liés. En 1809, le chimiste anglais William Hyde Wollaston a comparé les dérivés à la fois des oxydes de niobium-columbite, avec une densité de 5,918 g / cm 3, et tantale tantalite, avec une densité supérieure à 8 g / cm 3, et a conclu que les deux oxydes, en dépit de l'importante différence de densité, sont identiques; ainsi, il a gardé le nom de tantale. Cette conclusion a été contestée en 1846 par le chimiste allemand Heinrich Rose, qui ont fait valoir qu'il y avait deux éléments différents dans l'échantillon de tantalite et les nommés d'après les enfants de Tantalus: niobium (à partir Niobe), et pelopium (à partir de Pélops). Cette confusion est née des différences observées minimes entre le tantale et le niobium. Les nouveaux éléments revendiqués pelopium, ilmenium et Dianium étaient en fait identique au niobium ou des mélanges de niobium et de tantale.
Les différences entre le tantale et le niobium ont démontré sans équivoque en 1864 par Christian Wilhelm Blomstrand, et Henri Sainte-Claire Deville, ainsi que Louis J. Troost, qui a déterminé les formules de certains des composés en 1865 et enfin par le chimiste suisse Jean Charles Galissard de Marignac en 1866, qui ont tous prouvé qu'il n'y avait que deux éléments. Articles sur ilmenium continué à apparaître jusqu'en 1871.
De Marignac était le premier pour préparer le métal en 1864, quand il le chlorure de niobium réduit en le chauffant dans une atmosphère d' hydrogène . Bien que de Marignac était capable de produire du niobium gratuitement tantale sur une plus grande échelle par 1866, ce ne était pas jusqu'à ce que le début du 20e siècle que le niobium a été utilisé pour la première dans le commerce, filaments de la lampe à incandescence. Cette utilisation est rapidement devenu caduc par le remplacement de niobium avec du tungstène , qui a un point de fusion plus élevé et ne est donc préférable pour une utilisation dans les lampes à incandescence. La découverte que le niobium améliore la résistance de l'acier a été faite dans les années 1920, et cette application reste son utilisation prédominante. En 1961, le physicien américain Eugene Kunzler et ses collaborateurs à De Bell Labs a découvert que niobium-étain continue de présenter la supraconductivité en présence de forts courants électriques et des champs magnétiques, ce qui en fait le premier matériau de soutenir les forts courants et champs nécessaires pour les aimants de haute puissance utile et alimenté électriquement machines. Cette découverte permettrait - deux décennies plus tard - la production de longs câbles multi-brins qui pourraient être enroulée en bobines pour créer un grand, puissant électro-aimants pour les machines tournantes, les accélérateurs de particules, ou des détecteurs de particules.
Nommer de l'élément
Columbium (symbole Cb) était le nom donné à l'origine de cet élément par Hatchett, et ce nom est resté en usage dans des revues-américains le dernier document publié par American Chemical Society avec le niobium dans ses dates de titre de 1953 tout-niobium a été utilisé en Europe. Pour mettre fin à cette confusion, le nom de niobium a été choisi pour l'élément 41 à la 15e Conférence de l'Union de chimie à Amsterdam en 1949. Un an plus tard ce nom a été officiellement adopté par le Union internationale de chimie pure et appliquée (UICPA) après 100 années de controverse, en dépit de la priorité chronologique du nom Columbium. Le dernier nom est encore parfois utilisé dans l'industrie des États-Unis. Ce était une sorte de compromis; l'UICPA accepté de tungstène au lieu de Wolfram, par déférence pour l'utilisation en Amérique du Nord; et de niobium au lieu de niobium, par déférence pour l'utilisation européenne. Pas tout le monde d'accord, et alors que de nombreuses grandes sociétés chimiques et des organismes gouvernementaux se réfèrent à lui par le nom officiel de l'UICPA, de nombreux grands métallurgistes, les sociétés de métaux, et la Commission géologique des États-Unis se réfèrent toujours au métal par le "niobium" original.
Caractéristiques
Physique
Le niobium est un brillant, gris, ductile, paramagnétique métallique en groupe 5 du tableau périodique (voir tableau), même si elle a une configuration atypique dans sa plus à l'extérieur coquilles d'électrons par rapport au reste des membres. (Ceci peut être observé dans le voisinage de ruthénium (44), le rhodium (45), et du palladium (46).)
| Z | Élément | Nombre de électrons / shell |
|---|---|---|
| 23 | vanadium | 2, 8, 11, 2 |
| 41 | niobium | 2, 8, 18, 12, 1 |
| 73 | tantale | 2, 8, 18, 32, 11, 2 |
| 105 | dubnium | 2, 8, 18, 32, 32, 11, 2 |
Niobium devient un supraconducteur à des températures cryogéniques. A la pression atmosphérique, il a la plus haute température critique des supraconducteurs élémentaires: 9,2 K . Niobium possède la plus grande profondeur de pénétration magnétique de tout élément. En outre, il est l'un des trois élémentaire supraconducteurs de type II, avec le vanadium et le technétium . Les propriétés supraconductrices sont fortement dépendantes de la pureté du métal de niobium. Lorsque très pur, il est relativement mou et ductile, mais impuretés rendre plus difficile.
Le métal a une faible section efficace de capture pour les thermiques neutrons ; par conséquent il est utilisé dans les industries nucléaires.
Chimique
Le métal prend une teinte bleuâtre lorsqu'il est exposé à l'air à température ambiante pendant des périodes prolongées. Malgré la présentation d'un point de fusion élevé sous forme élémentaire (2468 ° C), il a une faible densité par rapport à d'autres métaux réfractaires. En outre, il est résistant à la corrosion, présente des propriétés de la supraconductivité, et les formes diélectrique des couches d'oxyde.
Le niobium est un peu moins électropositif et plus compact que le précédent dans la table périodique, de zirconium , alors qu'il est pratiquement identique en taille à des atomes de tantale plus lourds, en raison de la contraction lanthanide. En conséquence, les propriétés chimiques du niobium sont très semblables à ceux de tantale, qui apparaît directement en dessous de niobium dans le tableau périodique . Bien que sa résistance à la corrosion ne est pas aussi exceptionnelle que celle de tantale, son prix inférieur et une plus grande disponibilité en font le niobium attrayant pour des usages moins exigeants tels que les garnitures dans les usines chimiques.
Isotopes
Naturellement niobium survenant est composé d'un stable isotope , 93 Nb. En 2003, au moins 32 des radio-isotopes ont également été synthétisés, allant dans masse atomique de 81 à 113. Le plus stable de ceux-ci est 92 Nb avec une demi-vie de 34,7 millions d'années. L'un des moins stable est 113 Nb, avec une demi-vie estimée de 30 millisecondes. Isotopes plus légers que l'écurie 93 Nb tendance à la désintégration par β + décroissance, et ceux qui sont plus lourds ont tendance à pourrir par β -. désintégration, à quelques exceptions près 81 Nb, Nb 82, et 84 ont Nb β + mineure retardée chemins de désintégration du proton d'émission, 91 Nb désintègre par capture d'électrons et émission de positons, et 92 Nb se désintègre en deux β + et β - décroissance.
Au moins 25 isomères nucléaires ont été décrits, allant de la masse atomique de 84 à 104. Dans cette gamme, seulement 96 Nb, Nb 101, et 103 Nb ne ont pas isomères. Le plus stable des isomères de niobium est 93m Nb avec une demi-vie de 16,13 années. L'isomère moins stable est 84m Nb avec une demi-vie de 103 ns. Tout d'isomères la désintégration de niobium par transition isomérique ou désintégration bêta, sauf 92m1 Nb, qui a un mineur capture d'électrons chaîne de désintégration.
Occurrence
Le niobium est estimée à la 33e élément le plus commun dans la croûte de la Terre, avec 20 ppm. Certains pensent que l'abondance sur Terre devrait être beaucoup plus grande, mais que le niobium «manquant» peut être situé dans le noyau de la Terre en raison de haute densité du métal. L'élément libre ne est pas trouvée dans la nature, mais il ne se produit dans les minéraux. Minéraux qui contiennent du niobium contiennent souvent tantale, tels que colombite ((Fe, Mn) (Nb, Ta) 2 O 6) et colombo-tantalite (coltan ou, (Fe, Mn) (Ta, Nb) 2 O 6). Minéraux colombite-tantalite sont le plus souvent trouvé que minéraux accessoires dans intrusions pegmatitiques et dans les roches intrusives alcalines. Moins courantes sont les niobates de calcium , l'uranium , le thorium et le éléments de terres rares tels que pyrochlore ((Na, Ca) 2 Nb 2 O 6 (OH, F)) et euxenite ((Y, Ca, Ce, U, Th) (Nb, Ta, Ti) 2 O 6). Ces grands gisements de niobium ont été trouvés associés à (carbonatites carbonates silicate roches ignées ) et comme constituant de pyrochlore.
Les deux plus grands gisements de pyrochlore ont été trouvés dans les années 1950 au Brésil et au Canada, et les deux pays sont toujours les principaux producteurs de niobium concentrés de minéraux. Le plus grand gisement est hébergé dans une intrusion de carbonatite à Araxá, Minas Gerais Brésil, détenue par CBMM (Companhia Brasileira de Metalurgia e Mineração); l'autre gisement est situé dans Goiás et appartenant à Anglo American plc (à travers sa filiale Mineração Catalão), a également accueilli dans une intrusion de carbonatite. Au total, ces deux mines brésiliennes produisent environ 75% de l'offre mondiale. Le troisième plus grand producteur de niobium est la mine Niobec carbonatite-hébergé, Saint-Honouré proximité Chicoutimi, Québec détenue par Iamgold Corporation Ltd, qui produit environ 7% de l'offre mondiale.
Production

Après la séparation d'avec les autres minéraux, les oxydes mixtes de tantale Ta 2 O 5 et du niobium Nb 2 O 5 sont obtenus. La première étape du traitement est la réaction avec des oxydes acide fluorhydrique:
- Ta 2 O 5 + 14 HF → 2 H 2 [TaF 7] 5 + H 2 O
- Nb 2 O 5 + 10 HF → 2 H 2 [NbOF 5] 3 + H 2 O
La première séparation à l'échelle industrielle, développé par de Marignac, exploite les solubilités différentes du niobium et le tantale complexe fluorures, dipotassique oxypentafluoroniobate monohydraté (K 2 [NbOF 5] · H 2 O) et heptafluorotantalate dipotassique (K 2 [TaF 7]) dans l'eau. De nouveaux procédés utilisent l'extraction liquide des fluorures solution aqueuse par des solvants organiques tels que cyclohexanone. Les niobium et de tantale fluorures complexes sont extraits séparément du solvant organique avec de l'eau et soit précipité par l'addition de le fluorure de potassium pour produire un complexe de fluorure de potassium, ou précipité avec de l' ammoniac comme le pentoxyde de:
- H 2 [NbOF 5] 2 + KF → K 2 [NbOF 5] ↓ + 2 HF
Suivi par:
- 2 H 2 [NbOF 5] + 10 NH 4 OH → Nb 2 O 5 + ↓ 10 NH 4 F + 7 H 2 O
Plusieurs méthodes sont utilisées pour la réduction de niobium métallique. L' électrolyse d'un mélange fondu de K 2 [NbOF 5] et le chlorure de sodium est une; l'autre est la réduction du fluorure de sodium . Avec cette méthode, le niobium avec une pureté relativement élevée peut être obtenue. En production à grande échelle de la réduction de Nb 2 O 5 avec de l'hydrogène ou du carbone est utilisée. Dans le processus impliquant la réaction aluminothermique un mélange de l'oxyde de fer et l'oxyde de niobium est mis à réagir avec l'aluminium :
- 3 Nb 2 O 5 + Fe 2 O 3 + Al → 6 12 Nb + Fe + 2 6 Al 2 O 3
Pour améliorer la réaction, de petites quantités d'oxydants comme le nitrate de sodium sont ajoutés. Le résultat est l'oxyde d'aluminium et ferroniobium, un alliage de fer et de niobium utilisé dans la production d'acier. Le ferroniobium contient entre 60 et 70% de niobium. Sans addition de l'oxyde de fer, le procédé aluminothermique est utilisé pour la production de niobium. Une purification supplémentaire est nécessaire pour atteindre le degré de supraconducteurs alliages. Electron fusion par faisceau sous vide est la méthode utilisée par les deux grands distributeurs de niobium.
Le United States Geological Survey estime que la production a augmenté de 38 700 tonnes en 2005 à 44 500 tonnes en 2006. Les ressources mondiales sont estimées à 4,4 millions de tonnes. Au cours de la période de dix ans entre 1995 et 2005, la production a plus que doublé, à partir de 17 800 tonnes en 1995. Depuis 2009, la production est stable autour de 63 000 tonnes par an.
| Pays | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | 160 | 230 | 290 | 230 | 200 | 200 | 200 | ? | ? | ? | ? | ? |
| | 30000 | 22000 | 26000 | 29000 | 29900 | 35000 | 40000 | 57300 | 58000 | 58000 | 58000 | 58000 |
| | 2290 | 3200 | 3410 | 3280 | 3400 | 3310 | 4167 | 3020 | 4380 | 4330 | 4420 | 4400 |
| | ? | 50 | 50 | 13 | 52 | 25 | ? | ? | ? | ? | ? | ? |
| | ? | ? | 5 | 34 | 130 | 34 | 29 | ? | ? | ? | ? | ? |
| | 35 | 30 | 30 | 190 | 170 | 40 | 35 | ? | ? | ? | ? | ? |
| | 28 | 120 | 76 | 22 | 63 | 63 | 80 | ? | ? | ? | ? | ? |
| Monde | 32600 | 25600 | 29900 | 32800 | 34000 | 38700 | 44500 | 60400 | 62900 | 62900 | 62900 | 63000 |
Composés
Le niobium est à bien des égards similaires à tantale et le zirconium . Il réagit avec la plupart des non-métaux à des températures élevées: niobium réagit avec un atome de fluor à la température ambiante, avec du chlore et de l'hydrogène à 200 ° C , et avec de l'azote à 400 ° C, ce qui donne des produits qui sont fréquemment interstitielle et non stoechiométrique. Le métal commence à oxyder à l'air à 200 ° C , et est résistant à la corrosion par fusionnés aux alcalis et aux acides, y compris l'eau régale, chlorhydrique , sulfurique , nitrique et phosphorique . Le niobium est attaqué par de l'acide fluorhydrique et des mélanges d'acide fluorhydrique / acide nitrique.
Bien expositions niobium tous les états d'oxydation formels 5 à -1, dans les composés les plus fréquemment rencontrées, il se trouve dans l'état 5. De façon caractéristique, les composés dans les états d'oxydation moins 5+ affichage Nb Nb-collage.
Les oxydes et sulfures
formes de niobium oxydes avec les états d'oxydation (5 Nb 2 O 5), 4 ( NbO 2), et 3 (Nb 2 O 3), ainsi que de l'état d'oxydation +2 rares ( NBO). Le plus souvent rencontré est le pentoxyde, précurseur de presque tous les composés de niobium et des alliages. Niobates sont générés par la dissolution de pentoxyde de base hydroxyde solutions ou en faisant fondre dans les oxydes de métaux alcalins. Des exemples sont niobate de lithium (LiNbO 3) et le lanthane niobate (Lanbo 4). Dans le niobate de lithium est un trigone déformé perovskite-comme la structure, alors que le niobate de lanthane contient NbO 4 3- ions isolés. Le sulfure de niobium couches (NBS 2) est également connu.
Les matériaux présentant un revêtement de film mince de niobium (V) de l'oxyde peuvent être produits par dépôt chimique en phase vapeur ou les processus de dépôt de couche atomique, dans chaque cas par la décomposition thermique de niobium (V) ci-dessus éthylate 350 ° C.
Halogénures


Niobium forme halogénures dans les états d'oxydation de 5 et 4 ainsi que la diversité composés substoechiométriques. Les pentahalogénures (5) NBX fonction octaédriques de centres Nb. Niobium pentafluorure (NbF 5) est un solide blanc avec un point de 79,0 ° C et de fusion niobium pentachlorure (NbCl5) est jaune (voir l'image à gauche) avec un point de 203,4 ° C de fusion. Les deux sont hydrolyse pour donner les oxydes et les oxyhalogénures, tels que NbOCl 3. Le pentachlorure est un réactif polyvalent utilisé pour générer le des composés organométalliques, tels que niobocene dichlorure de ((C 5 H 5) 2 NbCl 2). Les tétrahalogénures (NBX 4) sont des polymères de couleur foncée avec des liaisons Nb-Nb, par exemple, le noir tétrafluorure hygroscopique de niobium (NbF 4) et brun niobium tétrachlorure (NbCl 4).
Halogénures de niobium anioniques sont bien connus, en partie à cause de la Lewis acidité des pentahalogénures. Le plus important est [NbF 7] 2-, qui est un intermédiaire dans la séparation de Nb et Ta à partir des minerais. Ce heptafluorure tend à former le oxopentafluoride plus facilement que ne les complexes d'halogénures de tantale compound.Other comprennent octaédrique [NbCl 6] -:
- Nb 2 Cl 10 + 2 Cl - → 2 [NbCl 6] -
Comme pour les autres métaux début, une variété de groupes d'halogénure réduits sont connus, par exemple le premier étant [Nb 6 Cl 18] 4-.
Les nitrures et les carbures
Autre composés binaires de niobium comprennent la du nitrure de niobium (NbN), qui devient un supraconducteur à basse température et est utilisé dans des détecteurs pour la lumière infrarouge. Le principal carbure de niobium est NBC, un très dur, réfractaire, matière céramique, utilisé dans le commerce bits d'outils pour outils de coupe.
Applications

On estime que de 44 500 tonnes de niobium minées en 2006, 90% a été utilisé dans la production de haute qualité acier de construction, suivie de son utilisation dans superalliages. L'utilisation d'alliages de niobium pour les supraconducteurs et dans les composants électroniques ne représentent qu'une petite part de la production.
La production d'acier
Le niobium est un efficace microalliage élément pour l'acier. Ajout de niobium de l'acier provoque la formation de carbure de niobium et le nitrure de niobium à l'intérieur de la structure de l'acier. Ces composés améliorent l'affinage des grains, le retard de la recristallisation, la précipitation et le durcissement de l'acier. Ces effets, à son tour augmenter la ténacité, la résistance, la formabilité et la soudabilité de l'acier microallié. Microallié Les aciers inoxydables ont une teneur en niobium est inférieure à 0,1%. Ce est un ajout d'alliage important de des aciers haute résistance faiblement alliés qui sont largement utilisés comme composants structuraux dans les voitures modernes. Ces alliages contenant du niobium sont solides et sont souvent utilisés dans la construction de pipelines.
Superalliages

Des quantités appréciables de l'élément, soit sous sa forme pure ou sous la forme de haute pureté et de ferroniobium nickel niobium, sont utilisés dans de nickel, de cobalt - et fer à base de superalliages pour des applications telles que moteurs à réaction des composants, turbines à gaz, des sous-ensembles de roquettes, des systèmes de chargeur de turbo et un équipement résistant à la chaleur et la combustion. Le niobium précipite un durcissement γ '' - phase à l'intérieur de la structure de grain de superalliage. Les alliages contiennent jusqu'à 6,5% de niobium. Un exemple d'un superalliage contenant du niobium est à base de nickel Inconel 718, qui se compose d'environ 50% de nickel , 18,6% de chrome , 18,5% de fer , 5% de niobium, 3,1% de molybdène , 0,9% de titane et 0,4% d'aluminium . Ces superalliages sont utilisés, par exemple, dans des systèmes de trames d'air de pointe telles que celles utilisées dans la Programme Gemini.
Un alliage utilisé pour liquides buses fusée de propulseurs, comme dans le moteur principal de la Modules lunaire d'Apollo, est C103, qui se compose de 89% de niobium, 10% d'hafnium et 1% de titane. Un autre alliage de niobium a été utilisé pour la buse de la Apollo module de service. Comme niobium est oxydé à des températures supérieures à 400 ° C, un revêtement de protection est nécessaire pour ces applications pour empêcher l'alliage de devenir cassant.
Aimants supraconducteurs

Niobium-germanium (Nb 3 Ge), niobium-étain (Nb3Sn), ainsi que la niobium-titane alliages sont utilisés en tant que type II fil supraconducteur pour aimants supraconducteurs. Les aimants supraconducteurs sont utilisés dans imagerie par résonance magnétique et instruments de résonance magnétique nucléaire, ainsi que dans des accélérateurs de particules. Par exemple, le Large Hadron Collider utilise 600 tonnes de brins supraconducteurs, tandis que le International Thermonuclear Experimental Reactor est estimé à utiliser 600 tonnes de Nb 3 brins Sn et 250 tonnes de brins NbTi. Dans la seule année 1992, fils de niobium-titane ont été utilisés pour construire plus de US $ de systèmes d'imagerie par résonance magnétique cliniques 1 milliard.
Supraconducteur, autre
Le Fréquence supraconducteur radio (RF) utilisé dans l'cavités lasers à électrons libres et TESLA XFEL sont fabriqués à partir de niobium pur.
La grande sensibilité de nitrure de niobium supraconducteur bolomètres en font un détecteur idéal pour un rayonnement électromagnétique dans la bande de fréquences THz. Ces détecteurs ont été testés à la Télescope submillimétrique Heinrich Hertz, le South Pole Telescope, le Télescope récepteur Lab, et au APEX et sont maintenant utilisés dans l'instrument HIFI à bord du Observatoire spatial Herschel.
D'autres utilisations
Electrocéramique
Le niobate de lithium, qui est un ferroélectrique, est largement utilisé dans les téléphones mobiles et modulateurs optiques et pour la fabrication de dispositifs à ondes de surface acoustiques. Il appartient à la ABO 3 ferroélectriques de structure comme le tantalate de lithium et titanate de baryum. Niobium a été évaluée comme une alternative moins chère à tantale condensateurs, mais condensateurs au tantale sont encore prédominantes. Le niobium est ajouté au verre afin d'atteindre un plus haut indice de réfraction, une propriété d'usage à l'industrie de l'optique dans la prise minces verres correcteurs .
Hypoallergénique applications: médecine et bijoux
Niobium et certains alliages de niobium sont physiologiquement inertes et ainsi hypoallergénique. Pour cette raison, le niobium se trouve dans de nombreux dispositifs médicaux comme les stimulateurs cardiaques. Le niobium traité avec de l'hydroxyde de sodium forme une couche poreuse qui facilite ostéointégration.
Avec le titane, le tantale et l'aluminium, le niobium peut également être chauffé électriquement, et anodisé, résultant dans un large éventail de couleurs en utilisant un processus appelé métal réactif anodisation qui est utile dans la fabrication de bijoux. Le fait que le niobium est hypoallergénique bénéficie également son utilisation dans les bijoux.
Numismatique
Le niobium est utilisé comme un métal précieux des pièces de monnaie commémoratives, souvent avec de l'argent ou de l'or. Par exemple, l'Autriche a produit une série de niobium d'argent euro pièces de monnaie à partir de 2003; la couleur de ces pièces est créé par le diffraction de la lumière par une couche mince d'oxyde produite par anodisation. En 2012, dix pièces sont disponibles montrant une grande variété de couleurs dans le centre de la pièce: bleu, vert, brun, pourpre, violet ou jaune. Deux autres exemples sont l'Autriche 2004 € 25 150 ans du chemin de fer alpin Semmering pièce commémorative, et les 25 2006 € Autriche European Satellite Navigation pièce de monnaie commémorative. La Monnaie autrichienne produite pour la Lettonie une série similaire de pièces à partir de 2004, avec une suite en 2007. En 2011, la Monnaie royale canadienne a commencé la production d'une pièce de 5 $ en argent sterling et en niobium nommé Moon Hunter dans lequel le niobium est oxydé sélectivement, ainsi créer des finitions uniques où aucun deux pièces sont exactement semblables.
Autre
Les joints du tube à arc de haute pression Les lampes à vapeur de sodium sont fabriqués à partir de niobium, ou du niobium avec 1% de zirconium , le niobium, car a un coefficient très proche de la dilatation thermique de la fritté alumine céramique de tube à arc, un matériau translucide qui résiste à l'attaque chimique ou réduction de la vapeur de sodium et du sodium liquide chaud contenu dans la lampe d'opération. Le métal est également utilisé dans des barres de soudage à l'arc pour stabiliser certaines nuances d'acier inoxydable. Il est également utilisé comme matériau dans les anodes pour les systèmes de protection cathodique sur des réservoirs d'eau, qui sont ensuite étalées généralement par le platine.
Précautions
Niobium a pas connu rôle biologique. Alors que la poussière de niobium est un irritant pour les yeux et la peau et un risque d'incendie, le niobium élémentaire sur une plus grande échelle est physiologiquement inerte (et donc hypoallergénique) et inoffensif. Il est fréquemment utilisé dans les bijoux et a été testé pour une utilisation dans certains implants médicaux.
Composés contenant du niobium sont rarement rencontrés par la plupart des gens, mais certains sont toxiques et doivent être traités avec soin. L'exposition à court et à long terme pour niobates et du chlorure de niobium, deux produits chimiques qui sont solubles dans l'eau, ont été testés chez des rats. Les rats traités avec une seule injection de pentachlorure de niobium ou un niobates montrent dose létale moyenne (DL 50) entre 10 et 100 mg / kg. Pour l'administration orale, la toxicité est faible; une étude avec des rats a donné un LD 50 après sept jours de 940 mg / kg.
