
Sélénium
À propos de ce écoles sélection Wikipedia
Cette sélection se fait pour les écoles par la charité pour enfants lire la suite . enfants SOS est le plus grand organisme de bienfaisance du monde en donnant des enfants orphelins et abandonnés la chance de la vie familiale.
| Sélénium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
34 Se | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
allotropes noir et rouge  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | sélénium, Se, 34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / s ɨ l Je n Je ə m / simul- LEE -neE-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | non métalliques parfois considéré comme un métalloïde | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | (16) chalcogènes, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 78,96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 3d 10 4s 2 4p 4 2, 8, 18, 6 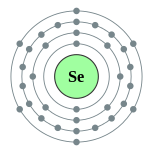 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Jöns Jakob Berzelius et Johann Gottlieb Gahn (1817) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Jöns Jakob Berzelius et Johann Gottlieb Gahn (1817) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | (Gris) 4,81 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | (Alpha) 4,39 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | (Vitreux) 4,28 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 3,99 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 494 K , 221 ° C, 430 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 958 K, 685 ° C, 1265 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 1766 K, 27,2 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | (Gris) 6,69 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 95,48 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 25,363 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 6, 4, 2, 1, -2 (Fortement acide oxyde) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 2,55 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 941,0 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 2045 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2973,7 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 120 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 120 ± 16 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 190 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
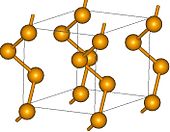
| Crystal structure | hexagonal  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | (Amorphe) 0,519 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) (amorphe) 37 um · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 3,350 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 10 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 3,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 8,3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 2.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 736 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7782-49-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes du sélénium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le sélénium est un élément chimique avec Se symbole et numéro atomique 34. C'est un non métallique dont les propriétés sont intermédiaires entre celles de la table périodique colonne adjacente chalcogène éléments soufre et le tellure . Il se produit rarement dans son état élémentaire dans la nature, ou des composés de minerai à l'état pur. Sélénium ( grec σελήνη Selene sens "Moon") a été découvert en 1817 par Jöns Jacob Berzelius, qui a noté la similitude du nouvel élément à l'précédemment connu tellure (appelé pour la Terre).
Le sélénium est présent dans le métal impurement minerais sulfurés, où il remplace partiellement le soufre. Commercialement, le sélénium est produit comme sous-produit dans le raffinage de ces minerais, le plus souvent pendant la production de cuivre. Minéraux qui sont séléniure ou sélénate composés purs sont connus, mais sont rares. Les usages commerciaux principaux pour le sélénium sont aujourd'hui dans la verrerie et des pigments . Le sélénium est un semi-conducteur et est utilisé dans photocellules. Utilisations dans l'électronique , jadis important, la plupart ont été supplanté par silicium dispositifs semi-conducteurs. Le sélénium continue d'être utilisé dans quelques types d'alimentation en courant continu parasurtenseurs et un type de fluorescente point quantique.
sels de sélénium sont toxiques en grandes quantités, mais l'état de traces sont nécessaires pour la fonction cellulaire dans de nombreux organismes, y compris tous les animaux. Le sélénium est un composant des enzymes antioxydantes le glutathion peroxydase et thiorédoxine réductase (qui réduisent indirectement certaines molécules oxydées chez les animaux et certaines plantes). Il se trouve aussi dans trois déiodinases enzymes qui convertissent une hormone de la thyroïde à l'autre. exigences de sélénium dans les plantes diffèrent selon les espèces, avec quelques plantes nécessitant des quantités relativement importantes, et d'autres apparemment nécessitant aucun.
Caractéristiques
Propriétés physiques
Le sélénium existe sous plusieurs formes allotropiques interconvertissent que lors d'un chauffage et un refroidissement effectué à différentes températures et les taux. Tel que préparé dans des réactions chimiques, le sélénium est habituellement , poudre de brique rouge amorphe. Lorsqu'il est fondu rapidement, il constitue la forme vitreuse noir, qui est habituellement vendu industriellement comme des perles. La structure du sélénium noir est irrégulière et complexe et se compose de bagues polymères avec jusqu'à 1000 atomes par cycle. Se Noir est un cassants, solide brillant qui est légèrement soluble dans CS 2. Lors du chauffage, il se ramollit à 50 ° C et se transforme en sélénium gris à 180 ° C; la température de transformation est réduite par la présence d'atomes d'halogène et les amines .
Les formes α, β et γ de couleur rouge sont produites à partir de solutions de sélénium noire en faisant varier les taux d'évaporation du solvant (en général CS 2). Ils ont tous relativement faible, symétries cristallines monocliniques et contiennent presque identiques plissées Se huit anneaux disposés en différents modes, comme dans le soufre . L'emballage est le plus dense dans la forme de α. Dans les huit Se anneaux, la distance Se-Se est 233,5 h et l'angle Se-Se-Se est 105,7 degrés. D'autres formes allotropiques du sélénium peuvent contenir 6 Se ou Se et sept anneaux.
La forme la plus stable et dense de sélénium a une couleur gris et hexagonale réseau cristallin constitué de chaînes polymères hélicoïdaux, dans lequel la distance Se-Se est 237,3 h et l'angle Se-Se-Se est 130,1 degrés. La distance minimale entre les chaînes est 343,6 h. Se gris est formé par chauffage modéré d'autres formes allotropiques, par refroidissement lent de fondu Se, ou par condensation de vapeurs de Se juste en dessous du point de fusion. Alors que d'autres formes de Se sont des isolants, gris Se est un semi-conducteur montrant sensible photoconductivité. Contrairement à d'autres formes allotropiques, ce est insoluble dans CS 2. Il résiste à l'oxydation par l'air et ne est pas attaqué par les acides non-oxydants. Avec des agents réducteurs forts, il forme polyselenides. Le sélénium ne présente pas les changements inhabituels dans la viscosité que le soufre subit lorsqu'il est chauffé progressivement.
Isotopes
Le sélénium a six naturellement isotopes , dont cinq sont stables: 74 Se, 76 Se, 77 Se, 78 Se et 80 Se. Les trois derniers se produisent aussi produits de fission, ainsi que 79 Se, qui a une demi-vie de 327.000 années. L'isotope naturel finale, 82 Se, a une demi-vie très longue (~ 10 20 ans, en décomposition par la double désintégration bêta à 82 Kr ), qui, pour des raisons pratiques, peut être considérée comme stable. Vingt-trois autres isotopes instables ont été caractérisés.
Voir également Selenium-79 pour plus d'informations sur les changements récents dans la demi-vie mesurée de ce produit de fission à vie longue, importants pour les calculs de dose effectués dans le cadre du stockage géologique à vie longue déchets radioactifs.
Les composés chimiques
composés de sélénium existent généralement dans les états d'oxydation -2, 2, 4, et 6.
Composés chalcogènes
Le sélénium forme deux oxydes: dioxyde de sélénium (SEO 2) et trioxyde de sélénium (SeO 3). Le dioxyde de sélénium est formé par la réaction de sélénium élémentaire avec de l'oxygène:
- Se 8 + 8 O 2 → 8 SeO 2

C'est un solide polymère qui forme des molécules monomères SeO 2 dans la phase gazeuse. Il se dissout dans l'eau pour former l'acide sélénieux, H 2 SeO 3. L'acide sélénieux peut également être faite directement par oxydation du sélénium élémentaire avec l'acide nitrique :
- 3 Se + 4 HNO 3 + H 2 O → H 2 SeO 3 + 4 NO 3
Contrairement soufre, qui forme une étable le trioxyde de sélénium trioxyde est thermodynamiquement instable et se décompose au-dessus de dioxyde 185 ° C:
- 2 SeO 3 → 2 SeO 2 + O 2 (AH = -54 kJ / mol)
Le sélénium trioxyde est produit dans le laboratoire par la réaction de anhydre sélénate de potassium (K 2 de SeO 4) et de trioxyde de soufre (SO 3).
Les sels de l'acide sélénieux sont appelés sélénites. Il se agit notamment sélénite de l'argent (Ag 2 SeO 3) et sélénite de sodium (Na 2 de SeO 3).
Le sulfure d'hydrogène réagit avec l'acide sélénieux aqueux pour produire le disulfure de sélénium:
- H 2 SeO 3 + 2 H 2 S → SeS 2 + 3 H 2 O
Le disulfure de sélénium est composé de cycles à 8 chaînons d'une distribution pratiquement statistique d'atomes de soufre et de sélénium. Il a une composition approximative de SES 2, avec des anneaux individuels variant en composition, comme Se 4 S 4 et S 6 Se 2. Le disulfure de sélénium est une utilisation dans un shampooing anti- Agent antipelliculaire, un inhibiteur de la chimie des polymères, un colorant de verre, et un agent réducteur dans feux d'artifice.
Le sélénium trioxyde peut être synthétisé par déshydratation l'acide sélénique, H 2 SeO 4, qui est lui-même produit par l'oxydation du dioxyde de sélénium avec le peroxyde d'hydrogène :
- SeO 2 + H 2 O 2 → H 2 SeO 4
L'acide sélénique à chaud, concentrée est capable de dissoudre l'or, formant or (III) sélénate.
composés halogènes
Iodures de sélénium ne sont pas bien connus. La seule stable est le chlorure de monochlorure sélénium (Se 2 Cl 2), ce qui pourrait être mieux connu comme le sélénium (I) le chlorure; le correspondant bromure est également connue. Ces espèces sont structurellement analogue au correspondant bichlorure. Le sélénium est un dichlorure réactif important dans la préparation de composés de sélénium (par exemple, la préparation de sélénium 7). Il est préparé par traitement avec du sélénium le chlorure de sulfuryle (SO 2 Cl 2). Le sélénium réagit avec le fluor pour former l'hexafluorure de sélénium:
- Se 8 F 24 + 2 → 8 SeF 6
En comparaison avec son homologue de soufre ( l'hexafluorure de soufre), l'hexafluorure de sélénium (SEF 6) est plus réactif et est un toxique irritant pulmonaire. Certains des oxyhalogénures de sélénium, tels que sélénium oxyfluorure (SEOF 2) et l'oxychlorure de sélénium (SeOCl 2) ont été utilisés comme solvants spéciaux.
Séléniures
Analogue au comportement d'autres chalcogènes, le sélénium forme un dihydrure de H 2 Se. Ce est un très odiferous gaz, toxique et incolore. Il est plus acide que le H 2 S. En solution, il se ionise à HSe -. Le séléniure dianion Se 2- forme une variété de composés, y compris les minéraux sélénium à partir de laquelle est obtenu dans le commerce. Séléniures illustratifs comprennent le séléniure de mercure (HgSe), le séléniure de plomb (PbSe) le séléniure de zinc (ZnSe), et cuivre indium et de gallium diséléniure (Cu (Ga, In) Se 2). Ces matériaux sont des semi-conducteurs . Avec des métaux électropositifs hautement tels que l'aluminium, ces séléniures sont sujettes à une hydrolyse:
- Al 2 Se 3 + 6 H 2 O → Al 2 O 3 + 6 H 2 Se
Séléniures de métaux alcalins réagissent avec le sélénium pour former polyselenides, Se 2-
x, qui existent sous forme de chaînes.
D'autres composés
Tetraselenium tétranitrure, Se 4 N 4, est un composé d'orange explosive analogue à Tétranitrure de tétrasoufre (S 4 N 4). Il peut être synthétisé par la réaction de le tétrachlorure de sélénium (LECS 4) avec [((CH 3) 3 Si) 2 N] 2 Se.
Le sélénium réagit avec cyanures pour donner des séléniocyanates:
- 8 KCN + Se → 8 8 KSeCN
Composés organoséléniés
Le sélénium, en particulier dans l'état d'oxydation II, forme des liaisons stables du carbone, qui sont structurellement analogues au correspondant des composés organo-soufrés. Surtout commune sont séléniures (R 2 Se, les analogues de thioéthers), diséléniures (R 2 Se 2, les analogues de disulfures), et sélénols (RSeH, des analogues de thiols). Les représentants des séléniures, diséléniures et sélénols comprennent respectivement sélénométhionine, diséléniure de diphényle, et Benzènesélénol. Le sulfoxyde en chimie du soufre est représenté par la chimie du sélénium dans les selenoxides formule (RSe (O) R), qui sont des intermédiaires dans la synthèse organique, comme l'illustre le réaction d'élimination sélénoxyde. Conformément aux tendances indiquées par le règle de la double liaison, selenoketones, R (C = Se) R, et selenaldehydes, R (C = Se) H, sont rarement observés.
Histoire
Sélénium ( grec σελήνη Selene sens "Moon") a été découvert en 1817 par Jöns Jakob Berzelius et Johan Gottlieb Gahn. Les deux chimistes possédaient une usine de chimie proximité Gripsholm, Suède produire de l'acide sulfurique par le processus de chambre plomb. La pyrite de la Falun mienne créé un précipité rouge dans les chambres de plomb qui était présumé être un composé de l'arsenic, et ainsi l'utilisation de la pyrite à fabriquer de l'acide a été abandonnée. Berzelius et Gahn voulaient utiliser la pyrite et ils ont également observé que le précipité rouge dégageait une odeur de raifort lorsqu'il est brûlé. Cette odeur ne était pas typique de l'arsenic, mais une odeur similaire a été connu du tellure composés. Par conséquent, la première lettre de Berzelius à Alexander Marcet a déclaré que ce était un composé de tellure. Toutefois, l'absence de composés du tellure dans la Falun minéraux de la mine a finalement conduit Berzelius à réanalyser le précipité rouge, et en 1818 il a écrit une seconde lettre à Marcet décrivant un élément nouvellement trouvé semblable à du soufre et de tellure. En raison de sa ressemblance avec le tellure, du nom de la Terre, Berzelius nommé le nouvel élément après la Lune .
En 1873, Willoughby Smith a constaté que la résistance électrique de sélénium gris était dépendante de la lumière ambiante. Cela a conduit à son utilisation en tant que cellule pour détecter la lumière. La première des produits commerciaux utilisant le sélénium ont été développés par Werner Siemens au milieu des années 1870. La cellule de sélénium a été utilisé dans la photophone développé par Alexander Graham Bell en 1879. Le sélénium transmet un courant électrique proportionnel à la quantité de lumière tombant sur sa surface. Ce phénomène a été utilisé dans la conception de mètres légères et de dispositifs similaires. Les propriétés semi-conductrices de sélénium ont trouvé de nombreuses autres applications dans l'électronique. Le développement de redresseurs de sélénium ont commencé au début des années 1930, et ceux-ci remplacés redresseurs d'oxyde de cuivre en raison de leur efficacité supérieures. Ces duré dans des applications commerciales jusqu'à ce que les années 1970, après quoi ils ont été remplacés par des moins coûteux et encore plus efficace redresseurs au silicium.
Le sélénium est venu à l'avis médical tard en raison de sa toxicité pour les êtres humains qui travaillent dans les industries. Le sélénium a également été reconnu comme une toxine vétérinaire importante, que l'on voit chez les animaux qui ont mangé des plantes de haute sélénium. En 1954, les premiers signes de fonctions biologiques spécifiques de sélénium ont été découverts dans micro-organismes. Son caractère essentiel pour la vie des mammifères a été découvert en 1957. Dans les années 1970, il a été montré pour être présent dans deux ensembles indépendants de enzymes. Ceci a été suivi par la découverte de sélénocystéine dans les protéines. Pendant les années 1980, il a été montré que la sélénocystéine est codée par le codon UGA . Le mécanisme de recodage a travaillé d'abord dans les bactéries , puis dans les mammifères (voir Élément SECIS).
Occurrence

Natif (c.-à-élémentaire) le sélénium est un minéral rare, qui ne fait pas habituellement de bons cristaux, mais, quand il le fait, ils sont rhomboèdres raide ou minuscule aciculaire des cristaux (ressemblant à des cheveux). Isolement de sélénium est souvent compliquée par la présence d'autres composés et éléments.
Le sélénium est naturellement présent dans un certain nombre de formes inorganiques, y compris selenide-, selenate-, et sélénite-contenant des minéraux, mais ces minéraux sont rares. Le minéral commun sélénite est pas un minéral de sélénium, et ne contient pas de ion sélénite, mais est plutôt un type de gypse (sulfate de calcium hydraté) nommé comme le sélénium pour la lune bien avant la découverte de sélénium. Le sélénium est le plus souvent trouvé assez impure, le remplacement d'une petite partie du soufre dans les minerais de sulfure de nombreux métaux.
Dans les systèmes biologiques, le sélénium se trouve dans les acides aminés sélénométhionine, sélénocystéine, et méthylsélénocystéine. Dans ces composés, le sélénium joue un rôle analogue à celui du soufre. Une autre origine naturelle organosélénium composé est le séléniure de diméthyle.
Certains solides sont riches en sélénium et le sélénium peuvent être bioconcentré par certaines plantes. Dans les sols, le sélénium se produit le plus souvent dans des formes solubles comme séléniate (analogues au sulfate), qui sont lessivés dans les rivières très facilement par le ruissellement. L'eau de mer contient des quantités importantes de sélénium.
Les sources anthropiques de sélénium comprennent la combustion du charbon et de l'extraction et de la fusion des minerais sulfurés.
Production
Le sélénium est le plus souvent produit à partir de dans de nombreux séléniure sulfure minerais, tels que ceux de cuivre , d'argent , ou plomb . Raffinage électrolytique de métal est particulièrement favorable à la production de sélénium en tant que sous-produit, et il est obtenu à partir de la la boue d'anode de raffineries de cuivre. Une autre source a été la boue de la chambres de plomb acide sulfurique plantes mais cette méthode pour produire de l'acide sulfurique ne est plus utilisé. Ces boues peuvent être traités par un certain nombre de moyens pour obtenir du sélénium. Cependant, le sélénium élémentaire est plus comme sous-produit de cuivre de raffinage ou de produire de l'acide sulfurique . Depuis l'invention de extraction par solvant et par voie électrolytique (SX / EW) pour la production de cuivre Cette méthode prend une part croissante de la production de cuivre large du monde. Cela modifie la disponibilité de sélénium, car seule une petite partie comparable du sélénium dans le minerai est lixivié avec le cuivre.
La production industrielle de sélénium implique généralement l'extraction de le dioxyde de sélénium à partir de résidus obtenus au cours de la purification de cuivre. Production commune à partir du résidu commence alors par oxydation avec le carbonate de sodium pour produire du dioxyde de sélénium. Le dioxyde de sélénium est ensuite mélangé avec de l'eau et la solution est acidifiée pour former l'acide sélénieux ( étape d'oxydation). Acide sélénieux est mis à barboter avec le dioxyde de soufre ( étape de réduction) pour donner sélénium élémentaire.
Environ 2.000 tonnes de sélénium a été produit en 2011 à travers le monde, principalement en Allemagne (650 t), le Japon (630 t), la Belgique (200 t) et la Russie (140 t), et le total des réserves ont été estimées à 93 000 tonnes. Toutefois, ces données excluent les deux principaux producteurs, les États-Unis et la Chine. Le prix a été relativement stable au cours de 2004-2010 à ~ $ 30 par livre (100 livres par beaucoup), mais a augmenté à 65 $ / lb en 2011. Une forte augmentation a été observée précédente en 2004 4-5 à 27 $ / kg. La consommation en 2010 a été divisé comme suit: métallurgie - 30%, la fabrication de verre - 30%, l'agriculture - 10%, les produits chimiques et des pigments - 10%, de l'électronique - 10%. La Chine est le consommateur dominante de sélénium à 1500-2000 tonnes / an.
Applications
Électrolyse Manganèse
Au cours de l'électro gagner de manganèse un ajout de dioxyde de sélénium diminue la puissance nécessaire pour faire fonctionner le des cellules d'électrolyse. La Chine est le plus grand consommateur de dioxyde de sélénium à cet effet. Pour chaque tonne de manganèse en moyenne de 2 kg d'oxyde de sélénium est utilisé.
La production de verre
La plus grande utilisation commerciale de Se, qui représente environ 50% de la consommation, est pour la production de verre. Se composés confèrent une couleur rouge au verre. Cette couleur annule les teintes vertes ou jaunes qui se posent des impuretés de fer qui sont typiques pour la plupart verre. A cet effet, divers sels de sélénite et séléniate sont ajoutés. Pour d'autres applications, la couleur rouge peut être souhaitable, dans lequel cas des mélanges de CdSe et CdS sont ajoutés.
Alliages
Le sélénium est utilisé avec du bismuth dans laitons pour remplacer plus toxiques de plomb . Le règlement du plomb dans les applications d'eau potable avec le Loi sur la salubrité de l'eau potable de 1974 fait une réduction du plomb en laiton nécessaire. Le nouveau laiton est commercialisé sous le nom EnviroBrass. Comme le plomb et le soufre, le sélénium permet d'améliorer l'usinabilité de l'acier à des concentrations de 0,15%. La même amélioration est également observée dans les alliages de cuivre et donc sélénium est également utilisé dans les alliages de cuivre usinables.
Cellules solaires
Cuivre gallium séléniure d'indium est un matériau utilisé dans la production de cellules solaires.
D'autres utilisations
De petites quantités de composés organoséléniés sont utilisés pour modifier la des catalyseurs de vulcanisation utilisés dans la fabrication de caoutchouc.
La demande pour le sélénium par l'industrie de l'électronique est en baisse, malgré un certain nombre de demandes de continuation. En raison de sa photovoltaïque et propriétés photoconductrices, le sélénium est utilisé dans photocopie, cellules photoélectriques, mètres légers et cellules solaires. Son utilisation comme photoconducteur dans les photocopieurs à papier était une fois une application de premier plan, mais dans les années 1980, la demande a diminué de photoconducteur (même se il était encore un grand-utilisation finale) que de plus en plus copieurs mis à l'utilisation de photoconducteurs organiques. Il était une fois largement utilisé dans redresseurs de sélénium. Ces utilisations ont pour la plupart été remplacés par des dispositifs à base de silicium ou sont en cours de remplacement. L'exception la plus notable est au pouvoir DC protection contre les surtensions, lorsque les capacités énergétiques supérieurs de suppresseurs de sélénium les rendent plus souhaitables que varistances d'oxyde métallique.
Séléniure de zinc était le premier matériau pour le bleu LED mais nitrure de gallium domine le marché aujourd'hui. Séléniure de cadmium a récemment joué un rôle important dans la fabrication de points quantiques. Feuilles de converti de sélénium amorphe images aux rayons X pour les modèles de charge de xéroradiographie et à l'état solide, à écran plat caméras x-ray.
Le sélénium est un catalyseur dans certaines réactions chimiques, mais elle ne est pas largement utilisé en raison de problèmes de toxicité. En Cristallographie aux rayons X, l'incorporation d'un ou plusieurs atomes de sélénium en place du soufre contribue à Multi-longueur d'onde dispersion anormale et Longueur d'onde unique dispersion anormale de phasage.
Le sélénium est utilisé dans le tonification des tirages photographiques, et il est vendu comme un toner par de nombreux fabricants photographiques. Son utilisation se intensifie et se étend la gamme de tons des images photographiques en noir et blanc et améliore la stabilité des tirages.
75 Se est utilisé comme source de rayons gamma dans la radiographie industrielle.
Rôle biologique
| NFPA 704 |
|---|
 0 2 0 |
| diamant incendie pour sélénium élémentaire |
Même se il est toxique à fortes doses, le sélénium est un élément essentiel micronutriments pour les animaux. Dans les usines, il se produit comme un minéral du spectateur, parfois dans des proportions toxiques dans fourrage (certaines plantes peut se accumuler le sélénium comme une défense contre être mangé par les animaux, mais d'autres plantes telles que locoweed nécessite sélénium, et leur croissance indique la présence de sélénium dans le sol). En savoir plus sur la nutrition des plantes ci-dessous.
Le sélénium est un composant de l'insolite acides aminés sélénocystéine et sélénométhionine. Chez l'homme, sélénium est un oligo-éléments en éléments nutritifs qui fonctionne comme cofacteur réduction des antioxydants tels que des enzymes, glutathion peroxydases et certaines formes de thiorédoxine réductase trouvé chez les animaux et certaines plantes (cette enzyme se produit dans tous les organismes vivants, mais pas toutes les formes de celui-ci dans les plantes exigent sélénium).
Le glutathion peroxydase famille d'enzymes (GSH-Px) catalyser certaines réactions qui éliminent les espèces réactives de l'oxygène tels que le peroxyde d'hydrogène et organique hydroperoxydes:
- 2 GSH + H 2 O 2 ---- GSH-Px → GSSG + 2 H 2 O
Le sélénium joue également un rôle dans le fonctionnement du glande thyroïde et dans chaque cellule qui utilise l'hormone thyroïdienne, en participant en tant que cofacteur pour trois des quatre types connus de l'hormone thyroïdienne désiodases, qui activent et désactivent alors diverses hormones thyroïdiennes et leurs métabolites: la désiodases iodothyronine sont la sous-famille d'enzymes qui utilisent déiodinases sélénium sous forme d'acide aminé rare autrement sélénocystéine. (Seul le déiodinase déiodinase iodotyrosine, qui travaille sur les derniers produits de dégradation de l'hormone thyroïdienne, ne pas utiliser le sélénium).
Le sélénium peut inhiber La maladie de Hashimoto, dans lequel les cellules de la thyroïde propres de l'organisme sont attaqués comme étranger. Une réduction de 21% sur les anticorps de TPO a été signalé avec l'apport alimentaire de 0,2 mg de sélénium.
L'apport de sélénium alimentaire accru réduire les effets de la toxicité du mercure et il est maintenant reconnu que le mécanisme moléculaire de la toxicité du mercure implique inhibition irréversible de sélénoenzymes qui sont nécessaires pour prévenir et inverser les dommages oxydatifs dans les tissus cérébraux et endocriniens.
Evolution en biologie
De il ya environ trois milliards d'années, les familles de sélénoprotéines procaryotes voiture l'évolution de la sélénocystéine. Le sélénium est incorporé dans plusieurs familles de sélénoprotéines procaryotes dans des bactéries, archées et eucaryotes comme sélénocystéine, où peroxyrédoxines de sélénoprotéines protègent les cellules bactériennes et eucaryotes contre les dommages oxydatifs. familles de sélénoprotéine de GSH-Px et les désiodases de cellules eucaryotes semblent avoir une infection bactérienne origine phylogénétique. Le formulaire contenant sélénocystéine-produit dans espèces aussi diverses que les algues vertes, les diatomées, oursin, poisson et le poulet. enzymes de sélénium sont impliqués dans l'utilisation des petites molécules réductrices le glutathion et thiorédoxine. Une famille de molécules contenant du sélénium (la glutathion peroxydases) détruisent les membranes cellulaires endommagées peroxydés de peroxyde et de réparation, en utilisant le glutathion. Une autre enzyme contenant du sélénium dans certaines plantes et chez les animaux ( thiorédoxine réductase) génère thiorédoxine réduite, un dithiol qui sert de source d'électrons pour les peroxydases et réduisant également l'enzyme importante ribonucléotide réductase qui rend précurseurs de l'ADN à partir de précurseurs d'ARN.
Les oligo-éléments impliqués dans la GSH-Px et activités des enzymes superoxyde dismutase, ce est à dire le sélénium, le vanadium , le magnésium , le cuivre et le zinc , peut-être fait défaut dans certaines zones minières déficient terrestres. Les organismes marins conservés et parfois élargi leurs séléno-protéomes, alors que les séléno-protéomes de certains organismes terrestres ont été réduits ou complètement perdus. Ces résultats suggèrent que, à l'exception des vertébrés , la vie aquatique soutient l'utilisation de sélénium, alors que les habitats terrestres conduisent à une utilisation réduite de cet oligo-élément. Poissons marins et les glandes thyroïdiennes vertébrés ont la plus forte concentration de sélénium et l'iode. D'environ 500 Mya, d'eau douce et des plantes terrestres optimisée lentement la production de «nouveaux» antioxydants endogènes comme l'acide ascorbique (vitamine C), polyphénols (flavonoïdes y compris), tocophérols, etc. Quelques-uns d'entre eux sont apparus plus récemment, dans les 50-200000000 dernières années, dans les fruits et les fleurs de plantes angiospermes. En fait, les angiospermes (le type dominant de l'usine d'aujourd'hui) et la plupart de leurs pigments antioxydants ont évolué au cours de la fin du Jurassique période.
Le déiodinase isoenzymes constituent une autre famille de sélénoprotéines eucaryotes avec fonction enzyme identifiée. Désiodases sont capables d'extraire les électrons des iodures et iodures de iodothyronines. Ils sont, par conséquent, impliqués dans la régulation de la thyroïde hormone, en participant à la protection des thyrocytes des dommages causés par H 2 O 2 produits pour la thyroïde biosynthèse des hormones. Environ 200 Mya, nouvelles sélénoprotéines ont été développés comme mammifères enzymes GSH-Px.
espèces végétales de l'indicateur
Certaines espèces de plantes sont considérées comme des indicateurs à forte teneur en sélénium du sol, car ils nécessitent des niveaux élevés de sélénium pour prospérer. Les principales plantes indicatrices de sélénium sont Astragalus espèces (y compris certains locoweeds), plume de prince ( Sp Stanleya.), Asters ligneuses ( Xylorhiza sp.), Et faux goldenweed ( Oonopsis sp.)
L'usage médical
La substance vaguement appelé le sulfure de sélénium (formule approximative SeS 2) est l'ingrédient actif dans certains shampooings antipelliculaires. Le composé de sélénium tue le champignon du cuir chevelu Malassezia, ce qui provoque la perte de fragments de peau sèche. L'ingrédient est également utilisé dans les lotions pour le corps à traiter Pityriasis versicolor due à une infection par une espèce différente de Malassezia champignon.
Détection dans des fluides biologiques
Le sélénium peut être mesurée dans le sang, le plasma, le sérum ou l'urine de suivre l'exposition environnementale ou professionnelle excessive, confirmer un diagnostic d'empoisonnement chez les victimes hospitalisés ou pour aider à une enquête médico-légale dans un cas de surdosage fatal. Certaines techniques analytiques sont capables de distinguer organique des formes inorganiques de l'élément. Les deux formes organiques et inorganiques de sélénium sont en grande partie convertis en monosaccharide conjugués (selenosugars) dans le corps avant d'être éliminé dans les urines. Les patients cancéreux recevant des doses orales quotidiennes de selenothionine peuvent atteindre des concentrations très élevées de plasma et l'urine sélénium.
Toxicité
Bien que le sélénium est un élément essentiel oligo-élément, il est toxique se il est pris en excès. Le dépassement de la Apport maximal tolérable de 400 microgrammes par jour peut conduire à sélénose. Cette 400 microgrammes ( ug) apport maximal tolérable est fondée principalement sur une étude de 1986 de cinq patients chinois qui présentaient des signes manifestes de sélénose et un suivi étude sur les mêmes cinq personnes en 1992. L'étude de 1992 fait trouvé l'alimentaire sans danger maximale Se apport à environ 800 microgrammes par jour (15 microgrammes par kilogramme de poids corporel), mais il a suggéré de 400 microgrammes par jour pour éviter non seulement toxicité, mais aussi pour éviter de créer un déséquilibre des nutriments dans l'alimentation et pour tenir compte des données provenant d'autres pays. En Chine, les gens qui ont ingéré du maïs cultivés dans extrêmement riche en sélénium du charbon de pierre (carbonée schiste) ont souffert de la toxicité du sélénium. Ce charbon a été montré pour avoir teneur en sélénium aussi élevé que 9,1%, la plus forte concentration dans le charbon jamais enregistrée dans la littérature.
Les symptômes de sélénose comprennent une odeur d'ail sur le souffle, troubles gastro-intestinaux, perte de cheveux, des ongles desquamation, fatigue, irritabilité, et des dommages neurologiques. Les cas extrêmes de sélénose peuvent entraîner la cirrhose du foie, œdème pulmonaire, et la mort. Sélénium élémentaire et plus métallique séléniures ont des toxicités relativement faibles en raison de leur faible biodisponibilité. Par contre, séléniates et sélénites sont très toxiques, ayant un mode d'oxydant d'action similaire à celle du trioxyde d'arsenic. La dose toxique de sélénite chronique pour l'homme est d'environ 2400 à 3000 microgrammes de sélénium par jour pendant une longue période. Séléniure d'hydrogène est un gaz extrêmement toxique corrosive. Le sélénium se produit également dans des composés organiques, tels que le séléniure de diméthyle, sélénométhionine, sélénocystéine et méthylsélénocystéine, qui ont tous élevé biodisponibilité et sont toxiques à fortes doses.
Le 19 Avril 2009, 21 poneys de polo sont morts peu de temps avant un match aux Etats-Unis Polo Ouvrir. Trois jours plus tard, une pharmacie a publié un communiqué expliquant que les chevaux avaient reçu une dose incorrecte de l'un des ingrédients utilisés dans un composé de supplément de vitamine / minéral qui avaient été incorrectement aggravé par une compoundage pharmacie. Analyse des taux sanguins des composés inorganiques dans le supplément indiqué les concentrations de sélénium étaient dix à quinze fois plus élevé que la normale dans les chevaux ' des échantillons de sang et de 15 à 20 fois plus élevé que la normale dans les échantillons de foie. Il a été confirmé plus tard que le sélénium était l'ingrédient en question.
intoxication sélénium des systèmes d'eau peut entraîner chaque fois de nouveaux cours de ruissellement agricoles, par le biais de terrains non aménagés normalement sèches. Ce processus se infiltre composés solubles naturelles de sélénium (comme séléniates) dans l'eau, qui peut ensuite être concentré dans les nouvelles «zones humides», comme l'eau se évapore. Des niveaux élevés de sélénium produites de cette façon ont été trouvés pour avoir causé certains troubles congénitaux chez les oiseaux des zones humides.

Chez les poissons et d'autres animaux sauvages, les faibles niveaux de sélénium causer une carence alors que les niveaux élevés causent la toxicité. Par exemple, dans le saumon, la concentration optimale de sélénium dans les tissus de poissons (corps) est d'environ 1 microgramme sélénium par gramme de tissu (poids sec). À des niveaux nettement inférieurs que la concentration, les jeunes saumons meurent de carence en sélénium; bien au-dessus de ce niveau, ils meurent de l'excès toxique.
Carence
La carence en sélénium est rare en bonne santé, les individus bien nourris. Il peut survenir chez les patients sévèrement compromise la fonction intestinale, ceux subissant nutrition parentérale totale, et dans celles d'un âge avancé (plus de 90). Aussi, les personnes dépendantes sur les aliments cultivés à partir du sol en sélénium déficiente sont à risque. Bien que la Nouvelle-Zélande a de faibles niveaux de sélénium dans son sol, les effets néfastes sur la santé ne ont pas été détectés.
Une déficience en sélénium tel que défini par faible (<60% de la normale) des niveaux d'activité de selenoenzyme dans les tissus du cerveau et le système endocrinien se produit uniquement lorsque l'état bas de sélénium est liée à un stress supplémentaire, tel que de fortes expositions au mercure ou à la suite d'une augmentation du stress oxydant dû de carence en vitamine E.
Il existe des interactions entre le sélénium et d'autres éléments nutritifs, tels que l'iode et la vitamine E. L'effet de la carence en sélénium sur la santé demeure incertain, en particulier en ce qui concerne La maladie de Kashin-Beck.
Dans certaines régions (par exemple diverses régions en Amérique du Nord), où de faibles niveaux de sélénium disponibles en plomb du sol à de faibles concentrations en matière sèche des plantes, la carence Se chez certaines espèces animales peuvent se produire à moins alimentaire (ou injecté) la supplémentation en sélénium est fait. Ruminants sont particulièrement sensibles. En général, l'absorption de sélénium alimentaire chez les ruminants est plus faible que chez les non-ruminants, et est plus faible que des fourrages de grain. Ruminants broutant certains fourrages, par exemple, certaines variétés de trèfle blanc contenant des glucosides cyanogénétiques, peuvent avoir des exigences de sélénium plus élevées, probablement en raison de cyanure de l'aglycone libéré par activité glucosidase dans le rumen et l'inactivation de glutathion peroxydases raison de l'effet de cyanure absorbée sur le glutathion fragment. Ruminants nouveau-nés à risque des ADM (maladie du muscle blanc) peuvent être administrés à la fois le sélénium et la vitamine E par injection; certains des myopathies ADM répondent uniquement aux sélénium, certains ne en vitamine E, et certains soit.
Effets sur la santé controversés
Un certain nombre d'études épidémiologiques corrélatifs ont impliqué une carence en sélénium (telle que mesurée par les niveaux sanguins) dans un certain nombre de maladies graves ou chroniques, comme le cancer, le diabète , le VIH / sida et la tuberculose . En outre, la supplémentation en sélénium a été trouvé pour être un chimiopréventif pour certains types de cancer dans certains types de rongeurs. Cependant, dans, aveuglés, essais prospectifs randomisés chez l'homme, la supplémentation en sélénium n'a pas réussi à réduire l'incidence d'une maladie, ni a une méta-analyse de ces études de supplémentation en sélénium détecté une diminution de la mortalité globale.
