
Gallium
Renseignements généraux
Enfants SOS ont produit une sélection d'articles de wikipedia pour les écoles depuis 2005. parrainage SOS enfant est cool!
| Gallium | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
31 Ga | |||||||||||||||||||
| |||||||||||||||||||
| Apparence | |||||||||||||||||||
blanc argenté  | |||||||||||||||||||
| Propriétés générales | |||||||||||||||||||
| Nom, symbole, nombre | gallium, Ga, 31 | ||||||||||||||||||
| Prononciation | / ɡ æ l Je ə m / GAL--ee əm | ||||||||||||||||||
| Élément Catégorie | post-métal de transition | ||||||||||||||||||
| Groupe, période, bloc | 13, 4, p | ||||||||||||||||||
| Poids atomique standard | 69,723 (1) | ||||||||||||||||||
| Configuration électronique | [ Ar ] 4s 2 4p 3d 10 1 2, 8, 18, 3  | ||||||||||||||||||
| Histoire | |||||||||||||||||||
| Prédiction | Dmitri Mendeleev (1871) | ||||||||||||||||||
| Découverte | Lecoq de Boisbaudran (1875) | ||||||||||||||||||
| Premier isolement | Lecoq de Boisbaudran (1875) | ||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||
| Phase | solide | ||||||||||||||||||
| Densité (à proximité rt) | 5,91 g · cm -3 | ||||||||||||||||||
| Liquid densité au mp | 6,095 g · cm -3 | ||||||||||||||||||
| Point de fusion | 302.9146 K , ° C 29,7646, 85,5763 ° F | ||||||||||||||||||
| Point d'ébullition | 2477 K, 2204 ° C, 3999 ° F | ||||||||||||||||||
| La chaleur de fusion | 5,59 kJ · mol -1 | ||||||||||||||||||
| Chaleur de vaporisation | 254 kJ · mol -1 | ||||||||||||||||||
| Capacité thermique molaire | 25,86 J · mol -1 · K -1 | ||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||
| |||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||
| États d'oxydation | 3, 2, 1 ( l'oxyde amphotère) | ||||||||||||||||||
| Électronégativité | 1,81 (échelle de Pauling) | ||||||||||||||||||
| énergies d'ionisation ( plus) | 1e: 578,8 kJ · mol -1 | ||||||||||||||||||
| 2ème: 1979,3 kJ · mol -1 | |||||||||||||||||||
| 3ème: 2963 kJ · mol -1 | |||||||||||||||||||
| Rayon atomique | 135 h | ||||||||||||||||||
| Rayon covalente | 122 ± 15 heures | ||||||||||||||||||
| Rayon de Van der Waals | 187 h | ||||||||||||||||||
| Miscellanées | |||||||||||||||||||
| Crystal structure | orthorhombique 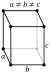 | ||||||||||||||||||
| Ordre magnétique | diamagnétique | ||||||||||||||||||
| Résistivité électrique | (20 ° C) 270 nΩ · m | ||||||||||||||||||
| Conductivité thermique | 40,6 W · m -1 · K -1 | ||||||||||||||||||
| Dilatation thermique | (25 ° C) 18 um · m -1 · K -1 | ||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 2,740 m · s -1 | ||||||||||||||||||
| Le module d'Young | 9,8 GPa | ||||||||||||||||||
| Coefficient de Poisson | 0,47 | ||||||||||||||||||
| Dureté Mohs | 1,5 | ||||||||||||||||||
| Dureté Brinell | 60 MPa | ||||||||||||||||||
| Numéro de registre CAS | 7440-55-3 | ||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||
| Article détaillé: Isotopes du gallium | |||||||||||||||||||
| |||||||||||||||||||
Le gallium est un élément chimique avec le symbole Ga et de numéro atomique 31. Gallium élémentaire ne se produit pas dans la nature, mais que le gallium (III) composés à l'état de traces dans bauxite et de zinc minerais. Un métallique argenté douce pauvre en métaux, de gallium élémentaire est un solide fragile à basse température. Tenue assez longtemps, le gallium va fondre dans la main comme il se liquéfie à une température de 29,76 ° C (85,57 ° F) (légèrement au-dessus température ambiante). Son point de fusion est utilisé comme point de référence de température. Alliage Galinstan (68,5% Ga, 21,5% En , 10% Sn ) a un point de fusion encore plus bas de -19 ° C (-2 ° F), bien en dessous du point de congélation de l'eau. De sa découverte en 1875 jusqu'à l'ère des semi-conducteurs, le gallium a été utilisé principalement comme un agent pour fabriquer des alliages bas point de fusion.
Aujourd'hui, la quasi-totalité de gallium est utilisé pour la microélectronique. L'arséniure de gallium, l'utilisation principale du gallium, est utilisé dans un circuit à micro-ondes et applications infrarouges. Le nitrure de gallium et nitrure de gallium indium, minoritaire semi-conducteurs utilise, produire bleu et violet des diodes électroluminescentes (LED) et des lasers à diode.
Gallium n'a aucun rôle connu en biologie. En raison de gallium (III) et ferriques sels comportent de manière similaire dans des systèmes biologiques, des ions gallium imitent souvent des ions fer dans les applications médicales. Contenant du gallium produits pharmaceutiques et radiopharmaceutiques ont été développés.
Propriétés physiques

Gallium élémentaire ne est pas trouvé dans la nature, mais il est facilement obtenu par fusion. Gallium métal très pur a une couleur argentée brillante et ses fractures métalliques solides conchoidally comme verre . Le gallium métal se dilate de 3,1% quand il se solidifie, et par conséquent dans des récipients de stockage soit de verre ou de métal est évitée en raison de la possibilité de rupture de récipient de congélation. part de Gallium l'état liquide de haute densité avec seulement quelques matériaux comme le silicium , le germanium , de bismuth et de l'eau .
Gallium attaque la plupart des autres métaux par diffuser dans leur métal treillis. Le gallium, par exemple, diffuse dans le joints de grains de Al / Zn alliages ou en acier , ce qui les rend très fragiles. Alliages de gallium facilement avec de nombreux métaux, et est utilisé en petites quantités en tant que plutonium alliage de gallium dans le plutonium noyaux de bombes nucléaires, pour aider à stabiliser la structure cristalline du plutonium.
Le point de fusion de 302.9146 K (29,7646 ° C, 85,5763 ° F) est la température ambiante à proximité, sur les températures moyennes de l'heure d'été. Le point de fusion de Gallium (mp) est l'un des points de référence de température formelles dans le Échelle internationale de température de 1990 (EIT-90) établie par BIPM. Le point triple de gallium de 302.9166 K (29,7666 ° C, 85,5799 ° F), est utilisé par NIST, de préférence à la température de fusion de gallium.
Le point de fusion unique de gallium permet de fondre dans sa main, puis recongeler en cas de renvoi. Ce métal a une forte tendance à supercool dessous de son point de fusion / point de congélation . Ensemencement avec un cristal aide à initier congélation. Le gallium est l'un des métaux (avec le césium , le rubidium , le mercure et susceptibles francium ) qui sont liquides à la température ambiante ou proche de la normale, et peut donc être utilisé en métal, en verre à haute température thermomètres. Il est également remarquable pour avoir une des plus larges gammes de liquides pour un métal, et (contrairement à mercure) pour avoir un faible pression de vapeur à des températures élevées. Le point d'ébullition de Gallium, 2477 K, est plus de huit fois plus élevé que son point de fusion sur le échelle absolue , ce qui en fait le plus grand rapport entre le point de fusion et le point de tout élément d'ébullition. Contrairement à mercure, gallium métal liquide mouille le verre et la peau, ce qui rend mécaniquement plus difficile à manipuler (même si elle est beaucoup moins toxique et nécessite beaucoup moins de précautions). Pour cette raison, ainsi que les problèmes de contamination métallique et la congélation extension, des échantillons de gallium métal sont généralement fournis dans des paquets de polyéthylène à l'intérieur d'autres conteneurs.
| Propriété | une | b | c |
|---|---|---|---|
| α (~ 25 ° C, um / m) | 16 | 11 | 31 |
| ρ (29,7 ° C, nΩ · m) | 543 | 174 | 81 |
| ρ (0 ° C, nΩ · m) | 480 | 154 | 71,6 |
| ρ (K 77, nΩ · m) | 101 | 30,8 | 14,3 |
| ρ (4,2 K, pΩ · m) | 13,8 | 6,8 | 1.6 |
Gallium ne pas cristalliser dans l'une quelconque des simples structures cristallines. La phase stable dans des conditions normales est orthorhombique avec 8 atomes dans le conventionnel cellule unitaire. Chaque atome a un seul voisin le plus proche (à une distance de 244 h) et six autres voisins dans supplémentaire de 39 h. Beaucoup stable et On trouve phases métastables comme fonction de la température et de la pression.
La liaison entre les deux voisins les plus proches est covalente, d'où Ga 2 dimères sont considérés comme les éléments constitutifs fondamentaux du cristal. Ceci explique la baisse du point de fusion par rapport à son voisin éléments de l'aluminium et l'indium.
Les propriétés physiques de gallium sont fortement anisotrope, ce est à dire avoir des valeurs différentes le long des trois axes majeurs cristallographique un (voir tableau), b et c; pour cette raison, il existe une différence significative entre le linéaire (α) et le volume des coefficients de dilatation thermique. Les propriétés de gallium sont également fortement dépendante de la température, en particulier près du point de fusion. Par exemple, le coefficient de dilatation thermique augmente de plusieurs centaines de pour cent lors de la fusion.
Propriétés chimiques
Le gallium se trouve principalement dans les trois état d'oxydation . L'oxydation 1 est également attestée dans certains composés, bien qu'ils tendent à disproportionné en gallium élémentaire et des composés du gallium (III). Ce qui est parfois appelé le gallium composés (II) sont en fait composés de l'Etat oxydation mixte contenant à la fois de gallium (I) et de gallium (III).
Composés chalcogènes
A température ambiante, le gallium métal est non réactive envers l'air et l'eau en raison de la formation d'une couche d'oxyde passif, de protection. Aux températures plus élevées, cependant, il réagit avec l'oxygène dans l'air pour former gallium (III), l'oxyde de Ga 2 O 3. La réduction de Ga 2 O 3, de gallium élémentaire sous vide à 500 ° C à 700 ° C donne le brun foncé gallium (I) oxyde, Ga 2 O. Ga 2 O est une très forte agent réducteur capable de réduire le H 2 SO 4 à H 2 S. Il dismutation à 800 ° C retour au gallium et Ga 2 O 3.
Sulfure de gallium, Ga 2 S 3, a trois modifications possibles de cristal. Elle peut être réalisée par la réaction avec de gallium l'hydrogène sulfuré (H 2 S) à 950 ° C. En variante, Ga (OH) 3 peut également être utilisé à 747 ° C:
- 2 Ga (OH) 3 + 3 H 2 S → Ga 2 S 3 + 6 H 2 O
La réaction d'un mélange de carbonates de métaux alcalins et de Ga 2 O 3 avec du H 2 S conduit à la formation de thiogallates contenant la [Ga 2 S 4] 2- anion. Les acides forts ces sels se décomposent, libérant H 2 S dans le processus. Le sel de mercure, HgGa 2 S 4, peut être utilisé comme un luminophore.
Gallium forme également des sulfures dans les états d'oxydation inférieurs, tels que gallium (II) le sulfure et le vert gallium (I) sulfure, ce dernier étant produit à partir de la première par chauffage à 1000 ° C sous un courant d'azote.
Les autres chalcogénures binaires, Ga 2 Se 3 et Ga 2 Te 3, avoir la structure blende. Ils sont tous les semi-conducteurs, mais sont facilement hydrolyse, ce qui limite leur utilité.
La chimie aqueuse
Les acides forts dissolvent gallium, formant gallium (III) tels que les sels Ga 2 (SO 4) 3 et Ga (NO 3) 3. Les solutions aqueuses de sels de gallium (III) contiennent l'ion gallium hydraté, [Ga (H 2 O) 6] 3+. Gallium (III) hydroxyde, Ga (OH) 3, peut être précipité à partir de gallium (III) les solutions en ajoutant de l'ammoniac . La déshydratation Ga (OH) 3 à 100 ° C produit de l'hydroxyde de l'oxyde de gallium, Gao (OH).
Alcalines hydroxyde solutions dissoudre le gallium, le gallate de former des sels contenant du Ga (OH) -
4 anion. l'hydroxyde de gallium, qui est amphotères, dissout aussi dans un alcali pour former des sels de gallate. Bien premiers travaux suggèrent Ga (OH) 3-
6 comme un autre anion gallate possible, cette espèce n'a pas été trouvé dans le travail plus tard.
Composés pnictogène
Le gallium réagit avec l'ammoniac à 1050 ° C pour former le nitrure de gallium, GaN. Gallium forme également des composés binaires avec le phosphore , l'arsenic et l'antimoine : phosphure de gallium (GaP), l'arséniure de gallium (GaAs), et antimoniure de gallium (GaSb). Ces composés ont la même structure que ZnS, et ont d'importantes semiconducteurs propriétés. GaP, GaAs, GaSb et peuvent être synthétisés par la réaction directe de gallium avec du phosphore élémentaire, de l'arsenic ou l'antimoine. Ils présentent une conductivité électrique plus élevée que GaN. GaP peut également être synthétisé par la réaction de Ga 2 O avec du phosphore à basse température.
Gallium fait également nitrures ternaires; par exemple:
- Li Ga 3 + N 2 → Li 3 GaN 2
Des composés similaires avec du phosphore et de l'arsenic existent également: Li 3 GaP 2 et Li 2 3 GaAs. Ces composés sont facilement hydrolysées par les acides dilués et l'eau.
Halogénures
Gallium (III) l'oxyde réagit avec des agents de fluoration tels que HF ou F 2 pour former gallium (III) de fluorure, GaF 3. Il se agit d'un composé ionique fortement insoluble dans l'eau. Toutefois, il ne se dissout en l'acide fluorhydrique, dans laquelle il forme un produit d'addition avec de l'eau, GaF 3 · 3H 2 O. Tenter de se déshydrater ce produit d'addition forme au lieu GaF 2 OH · n H 2 O. Le produit d'addition réagit avec l'ammoniac pour former GaF 3 · 3NH 3, qui peut alors être chauffé pour former GaF 3 anhydre.
Le trichlorure de gallium est formé par la réaction de gallium métallique avec du chlore gazeux. Contrairement au trifluorure de gallium (III) chlorure existe sous forme de molécules dimères, Ga 2 Cl 6, avec un point de 78 ° C de fusion. Ce est également le cas pour le bromure et l'iodure, Ga 2 Br 6 et Ga 2 I 6.
Comme l'autre groupe 13 trihalogénures, de gallium (III) sont les halogénures Les acides de Lewis, la réaction d'un halogénure comme accepteurs d'halogénures de métaux alcalins pour former des sels contenant GAX -
4 anions, où X est un halogène. Ils réagissent également avec des halogénures d'alkyle pour former carbocations et GAX -
4.
Lorsqu'il est chauffé à une température élevée, les halogénures de gallium (III) réagissent avec le gallium élémentaire gallium pour former les halogénures (I) respectifs. Par exemple, GaCl3 réagit avec Ga pour former GaCl:
- 2 Ga + GaCl3
 GaCl 3 (g)
GaCl 3 (g)
A des températures inférieures, l'équilibre se déplace vers la gauche et GaCl dismutation retour à gallium élémentaire et GaCl3. GaCl peut également être réalisée par la réaction avec du HCl de Ga à 950 ° C; il peut alors être condensée sous forme de solide rouge.
Gallium (I) les composés peuvent être stabilisés par formation d'adduits avec des acides de Lewis. Par exemple:
- GaCl + AlCl 3 → Ga + [AlCl 4] -
Les soi-disant "halogénures de gallium (II)", GAX, 2 sont en fait des produits d'addition de gallium (I) avec le gallium halogénures respectif (III) des halogénures, ayant la structure Ga + [GAX 4] -. Par exemple:
- GaCl + GaCl3 → Ga + [GaCl 4] -
composés d'hydrogène
Comme l'aluminium , le gallium constitue également un hydrure, GAH 3, connu sous le gallane, qui peut être obtenu par la réaction d'gallanate de lithium (LiGaH 4) avec gallium (III) chlorure à -30 ° C:
- 3 LiGaH 4 + GaCl 3 → 3 LiCl + 4 Gah 3
En présence de diméthyl éther comme solvant, Gah 3 polymérise pour (Gah 3) n. Si aucun solvant ne est utilisé, le dimère Ga 2 H 6 ( Digallane) est formé en tant que gaz. Sa structure est similaire à le diborane, ayant deux atomes d'hydrogène reliant les deux centres de gallium, contrairement α- AlH 3, dans lequel l'aluminium a un nombre de coordination de 6.
Gallane est instable au-dessus de -10 ° C, la décomposition de gallium élémentaire et de l'hydrogène.
Histoire
En 1871, l'existence de gallium a été prédit par le chimiste russe Dmitri Mendeleïev , qui l'a nommée " eka-aluminium "sur la base de sa position dans son tableau périodique . Il a également prédit plusieurs propriétés de l'élément, qui correspondent étroitement aux propriétés réelles de gallium, tels que la densité , le point de fusion , le caractère d'oxyde et de collage dans du chlorure.
Gallium a été découvert par spectroscopie par le chimiste français Paul Émile Lecoq de Boisbaudran en 1875 par son spectre caractéristique (deux lignes violettes) à l'examen d'un échantillon sphalérite. Plus tard cette année, Lecoq a obtenu le métal libre par électrolyse de son hydroxyde de solution d'hydroxyde de potassium. Il a nommé l'élément "Gallia", du latin sens Gallia Gaule, après sa terre natale de la France. Il a été plus tard affirmé que, dans un de ces multilingue calembours tant aimée des hommes de science au 19ème siècle, il avait également appelé le gallium après lui-même, comme son nom, "Le coq", est le français pour "la coq ", et le latin pour "coq" est "gallus"; cependant, dans un article 1877 Lecoq a nié cette supposition (Cf. la désignation de la. J / ψ meson et la planète naine Pluton .)
De sa découverte en 1875 jusqu'à l'ère des semi-conducteurs, de ses usages principaux étaient dans les applications thermométriques à haute température et à la préparation des alliages de métaux avec des propriétés inhabituelles de stabilité, ou la facilité de la fusion; certains étant liquide à la température ambiante ou au-dessous. Le développement de l'arséniure de gallium en tant que semi-conducteur à bande interdite directe dans les années 1960 a marqué le début de la phase la plus importante dans les applications de gallium.
Occurrence
Gallium ne existe pas sous forme libre dans la nature, et les quelques minéraux de grande gallium tels que gallite (CuGaS 2) sont trop rares pour servir de source primaire de l'élément ou de ses composés. Son abondance dans la croûte de la Terre est d'environ 16,9 ppm. Le gallium est trouvée et extraite en tant que composant de trace dans bauxite et dans une faible mesure à partir de sphalérite. La quantité extraite du charbon , diaspore et germanite dans lequel le gallium est également présent est négligeable. Le United States Geological Survey ( USGS) estime les réserves de gallium dépasser 1.000.000 tonnes, sur la base de 50 ppm de concentration en poids dans les réserves connues de bauxite et de zinc minerais. Certains cheminée On a montré que les poussières de la combustion du charbon pour contenir de petites quantités de gallium, typiquement inférieure à 1% en poids.
Production

Le gallium est un sous-produit de la production de l'aluminium et du zinc. Considérant que la sphalérite pour la production de zinc est la source mineure. La plupart gallium est extrait de l'brut solution d'hydroxyde d'aluminium de la Procédé Bayer pour la production de l'alumine et de l'aluminium. Une mercure cellule d'électrolyse et l'hydrolyse du l'amalgame avec de l'hydroxyde de sodium conduit à gallate de sodium. Électrolyse donne alors gallium métal. Pour semiconducteur utilisation, une purification supplémentaire est réalisée en utilisant fusion de zone, ou l'extraction de monocristal d'autre d'une fusion ( processus de Czochralski). Puretés de 99,9999% sont régulièrement atteints et largement disponibles dans le commerce.
En 1986, la production a été estimée à 40 tonnes. En 2007 la production de gallium était de 184 tonnes de moins de 100 tonnes de l'exploitation minière et le reste du recyclage de la ferraille. En 2011 la production mondiale de gallium était estimée à 216 tonnes.
Applications
Les applications de semi-conducteurs dominent l'utilisation commerciale de gallium, qui représente 98% des demandes. La prochaine grande application est pour des grenats de gadolinium gallium.
Semi-conducteurs

En raison de cette demande, de très haute pureté (+ 99,9999%) gallium est disponible dans le commerce. Arséniure de gallium (GaAs) et le nitrure de gallium (GaN) utilisée dans les composants électroniques représentés sur 98% de la consommation de gallium aux Etats-Unis en 2007. Environ 66% de semi-conducteur de gallium est utilisé aux Etats-Unis dans les circuits intégrés (en arséniure principalement de gallium), tels que la fabrication des ultra -Dessiccateurs puces logiques de vitesse et MESFETs pour faible bruit préamplis micro-ondes dans les téléphones cellulaires. Environ 20% est utilisé dans optoélectronique. Dans le monde, l'arséniure de gallium représente 95% de la consommation mondiale annuelle de gallium.
L'arséniure de gallium est utilisé en optoélectronique dans une variété d'applications infrarouges. arséniure de gallium d'aluminium (AlGaAs) est utilisé dans les diodes laser de grande puissance infrarouge. En tant que composante des semi-conducteurs le nitrure de gallium et d'indium et nitrure de gallium, le gallium est utilisé pour produire des dispositifs optoélectroniques bleus et violets, essentiellement les diodes laser et diodes émettrices de lumière. Par exemple, nitrure de gallium lasers à diode 405 nm sont utilisées en tant que source de lumière violette à haute densité de stockage de données de disque compact, dans la Blu-ray Disc standard.
Cellules photovoltaïques à jonctions multiples, développé pour applications de puissance de satellite, sont prises par épitaxie par faisceau moléculaire ou épitaxie organométallique en phase vapeur de des films minces de l'arséniure de gallium, phosphure de gallium indium ou gallium indium arsenide.The Mars Exploration Rovers et plusieurs satellites utilisent jonction triple arséniure de gallium sur les cellules germanium. Le gallium est également un composant à composés photovoltaïques (tels que le sulfure de cuivre indium gallium sélénium ou de Cu (In, Ga) (Se, S) 2) pour une utilisation dans les panneaux solaires comme une alternative rentable à silicium cristallin.
Galinstan et d'autres alliages
Gallium facilement alliages avec la plupart des métaux, et a été utilisé en tant que composant alliages bas point de fusion. A près alliage eutectique de gallium, d'indium et d'étain est un liquide à température ambiante qui est disponible dans les thermomètres médicaux. Cet alliage, avec le nom commercial Galinstan (avec le "-stan", se référant à l'étain), a un bas point de congélation de -19 ° C (-2,2 ° C). Il a été suggéré que cette famille d'alliages pourrait également être utilisée pour refroidir les puces d'ordinateur à la place de l'eau. alliages de gallium ont été évalués de remplacer le mercure amalgames dentaires, mais ces matériaux ne ont pas encore de voir une large acceptation.
Parce que le gallium mouille verre ou la porcelaine, le gallium peut être utilisé pour créer brillant miroirs. Lorsque l'action de mouillage de gallium-alliages ne est pas souhaitée (comme dans Galinstan Les thermomètres en verre), le verre doit être protégé par une couche transparente de gallium (III) oxyde.
Le plutonium utilisé dans fosses d'armes nucléaires est usinée par alliage de gallium pour stabiliser son la phase δ.
Le gallium ajouté en quantités jusqu'à 2% en commun soudures peuvent aider caractéristiques de mouillage et d'écoulement.
Les alliages de Al et Ga ont été évalués pour la production d'hydrogène.
Il est utilisé comme élément d'alliage dans le alliage magnétique à mémoire de forme Ni-Mn-Ga.
Applications biomédicales
Bien que le gallium a aucun rôle connu en biologie, qu'il imite fer (III), l'ion gallium et se localise sur interagit avec de nombreux processus dans l'organisme dans lesquels le fer (III) est manipulé. Comme ces procédés comprennent l'inflammation, qui est un marqueur de nombreux états pathologiques, plusieurs sels de gallium sont utilisés ou sont en développement, à la fois produits pharmaceutiques et radiopharmaceutiques en médecine. Lorsque des ions gallium sont prises par erreur par des bactéries telles que Pseudomonas, la capacité des bactéries à respirer est entravée et de l'bactéries meurent. Le mécanisme sous-jacente est que le fer est redox actif, ce qui permet le transfert d'électrons au cours de la respiration, mais gallium redox est inactif.
Nitrate de gallium (nom de marque Ganite) a été utilisé comme un produit pharmaceutique par voie intraveineuse pour traiter hypercalcémie associée à des tumeurs métastases aux os. Le gallium est pensé pour interférer avec la fonction des ostéoclastes. Il peut être efficace lorsque les autres traitements pour hypercalcémie maligancy-associé ne sont pas.
- Gallium maltolate, absorbable par voie orale une forme de gallium (III) ion, est en essais cliniques et précliniques en tant que traitement potentiel pour un certain nombre de types de cancer, les maladies infectieuses et les maladies inflammatoires.
Un complexe amine - phénol Ga (III) composé MR045 a été trouvé pour être sélectivement toxique pour les parasites qui ont développé une résistance à chloroquine, un médicament commun contre le paludisme . Tant le Ga (III) fait complexe et la chloroquine en inhibant la cristallisation de hémozoïne, un produit formé d'élimination de la digestion de sang par les parasites.
Sels Radiogallium
Gallium-67 des sels tels que le gallium citrate de gallium et le nitrate sont utilisés comme agents radiopharmaceutiques dans un médecine nucléaire procédure d'imagerie communément appelée scintigraphie au gallium. La forme ou le sel de gallium est sans importance. Pour ces applications, la isotope radioactif 67 Ga est utilisé. Le corps gère Ga 3+ à bien des égards comme se il se agissait de fer, et par conséquent il est lié (et concentre) dans les zones d'inflammation, telles que l'infection, ainsi que les zones de division cellulaire rapide. Cela permet de tels sites à imager par des techniques d'analyse nucléaires. Cette utilisation a été largement remplacée par fluorodésoxyglucose (FDG) pour tomographie par émission de positons, "PET" scans de leucocytes marqués numérisation et l'indium-111. Cependant, la localisation de gallium dans le corps possède des propriétés qui le rendent unique dans certaines circonstances, de modalités concurrentes utilisant d'autres radio-isotopes.
Gallium-68, un émetteur de positons avec une demi-vie de 68 min., Est maintenant utilisé comme un radionucléide de diagnostic dans le PET-CT lorsqu'ils sont liés à des préparations pharmaceutiques telles que DOTATOC, un analogue de la somatostatine utilisé pour tumeurs neuroendocriniennes enquête, et DOTA-Tate, une plus récente, utilisé pour neuroendocrine métastase et cancer neuroendocrine du poumon, tels que certains types de microcytoma. La préparation de Galium-68 comme produit pharmaceutique est chimique et le radionucléide est extrait par élution de germanium-68, un radio-isotope synthétique de germanium , en gallium-68 générateurs.
D'autres utilisations
- Magnésium gallate contenant des impuretés (tels que Mn 2+), commence à être utilisé dans l'ultraviolet -activated poudre de phosphore.
- la détection des neutrinos. Peut-être la plus grande quantité de gallium pur jamais collecté en un seul endroit est le télescope de neutrinos de gallium-Germanium utilisé par le Expérience SAGE à l'Observatoire de neutrinos de Baksan en Russie. Ce détecteur contient de 55 à 57 tonnes de gallium liquide. Une autre expérience a été le Détecteur de neutrinos GALLEX opéré au début des années 1990 dans un tunnel de montagne italienne. Le détecteur contenait 12,2 tonnes de gallium-71 arrosé. Neutrinos solaires causé quelques atomes de 71 Ga à devenir radioactifs 71 Ge , qui ont été détectés. Le flux de neutrinos solaire déduite est révélé avoir un déficit de 40% de la théorie. Cela n'a pas été expliqué que de meilleurs détecteurs et des théories de neutrinos solaires ont été construites (voir SNO).
- Comme un Source d'ions à métal liquide pour un faisceau d'ions focalisé. Par exemple, un faisceau focalisé-gallium-ion a été utilisé pour créer le plus petit livre du monde, Teeny Ted de Navet Ville.
- Dans une farce classique, les scientifiques façonner cuillères de gallium et de servir le thé aux clients peu méfiants. Les cuillères fondent dans le thé chaud.
- Comme additif dans fart de glisse pour les skis, et d'autres matériaux de surface à faible friction. US 5069803, Sugimura, Kentaro; Shoji Hasimoto & Takayuki Ono, "Utilisation d'une composition de résine synthétique contenant des particules de gallium dans le matériau de surface de glisse des skis et d'autres applications", publié 1995
Précautions
L'ion Ga (III) de sels de gallium soluble a tendance à former de l'hydroxyde insoluble lorsqu'il est injecté en grandes quantités, et chez les animaux de cette précipitation a entraîné une toxicité rénale. En doses plus faibles, le gallium soluble est bien toléré, et ne se accumule pas comme un poison.
Alors que le gallium métallique ne est pas considéré comme toxique, les données ne sont pas concluants. Certaines sources indiquent que cela peut causer dermatite d'une exposition prolongée; d'autres tests ne ont pas provoqué une réaction positive. Comme la plupart des métaux, le gallium finement divisée perd son éclat et le gallium poudre apparaît gris. Ainsi, lorsque le gallium est manipulé à mains nues, la dispersion extrêmement fine de gouttelettes liquides de gallium, qui résulte de mouiller la peau avec le métal, peut apparaître comme une tache grise de la peau.
